CLORIDRATO DE BETAÍNA NA HIPOCLORODRIA E ACLORIDRIA

CLORIDRATO DE BETAÍNA NA HIPOCLORODRIA E ACLORIDRIA
Anderson de Oliveira Ferreira, Farm., MSc, PhD(cand.)
Introdução
Em indivíduos saudáveis, após a ingestão de alimentos, espera-se a ocorrência da secreção de ácido clorídrico (HCl) pelas células parietais do estômago. A acidificação do conteúdo gástrico promove a ativação da pepsina, uma enzima proteolítica importante na digestão de proteínas. Adicionalmente, vários estudos indicam que o ácido gástrico HCl pode aumentar a absorção de vários nutrientes, incluindo ferro, zinco, cobre, ácido fólico, vitamina B3 e betacaroteno. A absorção de vitamina B12 presente nos alimentos também requer a secreção e presença de HCl. O mesmo não ocorre em relação a vitamina B12 cristalina sintética, sobre a qual o HCl não exerce efeito no aumento de sua absorção. Essa diferença parece ser devida ao fato onde a vitamina B12 derivada de alimentos apresentaria-se ligada à proteína e para ser liberada e absorvida necessitaria da ação da pepsina. O ácido gástrico também desempenha um papel relevante na liberação e subsequente absorção de compostos bioativos presentes em plantas medicinais, função que explicaria em parte a efetividade de fitoterápicos em alguns indivíduos e a ausência em outros para uma mesma condição clínica (NIWA et al., 1991; GABY, 2011).
A hipocloridria e a acloridria são respectivamente definidas como a falta ou ausência de ácido (HCl) no fluido gástrico (YAGO et al., 2013). A acloridria e a hipocloridria poderiam potencialmente resultar na redução de vários nutrientes listados anteriormente, levando potencialmente a deficiências nutricionais. A fase gástrica da digestão de proteínas também pode ser prejudicada nas pessoas com hipocloridria, embora enzimas secretadas pelo pâncreas possam superar parcialmente essa deficiência. A digestão incompleta de proteína compromete o status nutricional proteico e aumenta a absorção de macromoléculas potencialmente alergênicas (GRAY; WALZER, 1936; SCHOLL et al., 2005). De fato, quando as proteínas não são digeridas em aminoácidos, dipeptídeos e polipeptídeos de cadeia curta; elas retêm suas propriedades antigênicas. Essas moléculas antigênicas são então expostas ao sistema imune ou absorvidas através da permeação favorecida pelo afrouxamento de junções intercelulares do intestino, ocasionando um estado crônico de hipersensibilidade (PIZZORNO; MURRAY, 2000). Análises fracionais gástricas de 200 crianças asmáticas realizadas por Bray mostraram que 80% dos indivíduos avaliados apresentavam secreções ácidas abaixo dos níveis normais (BRAY, 1931). Essa alta ocorrência sugere que a produção de acidez gástrica diminuída poderia predispor essas crianças a alergias alimentares.
Além do papel importante na absorção de nutrientes, o ácido gástrico também apresenta uma função barreira, eliminando vários microorganismos patogênicos que de outra forma poderiam colonizar o trato gastrintestinal. O suco gástrico é bactericida em pH igual ou menor que 3,0. Indivíduos com hipocloridria apresentam risco maior para o aumento do crescimento bacteriano e de fungos, bem como para infestação por parasitas intestinais (GABY, 2011). O aumento da incidência de câncer no estômago tem sido observado em pessoas com acloridria, possivelmente explicado pela produção aumentada de nitrosaminas derivadas de nitritos intragástricos (RUDDEL, 1978).
Embora alguns pacientes possam permanecer assintomáticos mesmo com uma completa ausência de ácido gástrico, alguns sinais e sintomas têm sido relacionados com a baixa acidez gástrica; como a ocorrência de inchaço ou distensão abdominal, eructação, queimação e flatulência imediatamente após as refeições, mal-estar; indigestão, diarréia ou constipação, presença de alimentos não digeridos nas fezes, boca seca, glossite; alergias a múltiplos alimentos, náusea, prurido anal, fraqueza, descamação cutânea, unhas quebradiças, dilatação de vasos sanguíneos nas bochechas e nariz, sensação prolongada de plenitude após alimentação, náusea e náusea após tomar suplementos, acne, deficiência de ferro, parasitose intestinal crônica, flora intestinal anormal e candidíase crônica (KELLY, 1997; PIZZORNO; MURRAY, 2000).
A maioria das pesquisas tem mostrado que a secreção ácida gástrica declina com o envelhecimento. A gastrite atrófica é uma causa comum de hipocloridria e acloridria, podendo ser resultante da destruição imune das células parietais gástricas ou pela infecção por Helicobacter pylori (GABY, 2011). Estima-se que cerca de 30% dos idosos acima de 60 anos possuem gastrite atrófica e cerca de 40% das mulheres pós-menopausadas não apresentam secreção ácida basal (KELLY, 1997). A acloridria e hipocloridria também podem ser causadas pelo tratamento prolongado com inibidores da bomba de prótons (ex. omeprazol, rabeprazol), comprometendo inclusive a absorção de fármacos com natureza química de base fraca (ex. cetoconazol, itraconazol, tiroxina, dipiridamol, atazanavir, enoxacina, dasatinibe) que exibem solubilidade pH-dependente quando administrados sob condições hipoclorídricas (YAGO et al., 2013; CORLETO et al., 2014; YAGO et al., 2014). O uso prolongado dessa classe de antiulcerosos também pode interferir negativamente na absorção de nutrientes, incluindo do ferro, cálcio, magnésio e vitamina B12, ocasionando potencialmente deficiências nutricionais (CORLETO et al., 2014).
Vários estudos relatam a prevalência da hipocloridria ou acloridria em associação com certas condições clínicas, incluindo anemia/anemia perniciosa, artrite, asma (em crianças), doença celíaca, carcinoma do estômago, distúrbios autoimunes crônicos, depressão, dermatite herpetiforme, diabetes mellitus, neuropatia diabética, eczema, dispepsia flatulenta, cálculo biliar, pólipos gástricos, gastrite, hepatite, hipertiroidismo/doença de Graves, hipotiroidismo, lúpus eritematoso, miastenia gravis, osteoporose, psoríase, rosácea, doença de Sjogren, tireotoxicose, colite ulcerativa, vitiligo, neuralgia do trigêmio e insuficiência cardíaca congestiva (KELLY, 1997; PIZZORNO; MURRAY, 2000; GABY, 2011).
O tratamento da hipocloridria e acloridria é usualmente direcionado à causa primária, incluindo a reacidificação gástrica através da suplementação indireta oral de ácido clorídrico primariamente com cloridrato de betaína, embora o cloridrato de ácido glutâmico e o próprio ácido clorídrico diluído também sejam ainda eventualmente empregados para essa finalidade (WOSIKA, 1936; KNAPP, 1991; KELLY, 1997; THOME RESEARCH Inc., 2002; YAGO et al. ,2013; YAGO et al., 2014).
Cloridrato de Betaína: descrição e farmacologia
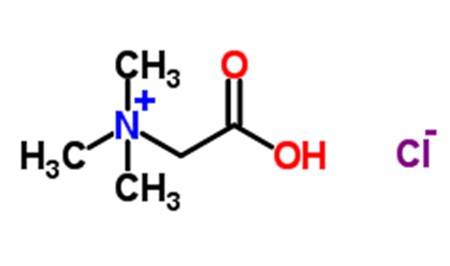
Figura 1: Fórmula estrutural do cloridrato de betaína
O cloridrato de betaína (C5H11NO2.HCl; PM=153,6) é derivado da betaína ou trimetilglicina, um composto quaternário de amônio inicialmente descoberto no suco de açúcar de beterraba (Beta vulgaris) (HENDLER; RORVIK, 2008). Apresenta-se como pó cristalino branco ou incolor e quando dissolvido em água, o cloridrato de betaína hidrolisa-se e cerca de 25% do seu peso forma ácido clorídrico (HCl). O pH de uma solução aquosa de cloridrato de betaína a 10%(p/v) varia de 1,0 a 1,5, portanto significativamente ácida (BLACOW, 1972).
O cloridrato de betaína constitui-se em um agente nutracêutico utilizado como fonte de ácido clorídrico, administrado de forma isolada ou em associações por via oral para tratamento da hipocloridria, auxiliar a digestão, hepatoproteção e aumentar os níveis de potássio (KRINSKY et al.,2003; HENDLER; RORVIK, 2008).
Administrado como forma farmacêutica sólida oral (ex. cápsula, comprimido, pó), o cloridrato de betaína acidifica o fluido gástrico através da dissociação em betaína livre e ácido clorídrico, baixando dessa forma o pH gástrico (YAGO et al., 2014). O cloridrato de betaína é convertido em betaína no ambiente alcalino do intestino delgado onde a betaína é absorvida pelos enterócitos, sendo liberada na circulação portal e através desta levada ao fígado onde há significante metabolismo de extração de primeira passagem e metabolismo de primeira passagem da betaína. A principal reação metabólica é a transferência de um grupo metila da betaína para homocisteína via a enzima betaína-homocisteína-metiltransferase. Os produtos dessa reação são L-metionina e dimetilglicina (HENDLER; RORVIK, 2008).
A dose típica de cloridrato de betaína utilizada para o alívio dos sintomas da acloridria e como auxiliar na digestão (como digestivo é usualmente associado à pepsina) varia aproximadamente 325mg a 650mg administradas nas refeições, sendo que doses menores e maiores também são relatadas (BLACOW, 1972; KELLY, 1997; KRINSKY et al., 2003; HENDLER; RORVIK, 2008).
Eficácia do Cloridrato de betaína no tratamento da acloridria/hipocloridria e na reacidificação gástrica após acloridria induzida farmacologicamente
Em um estudo conduzido por Sharp e Fister , vinte e sete pacientes com acloridria foram suplementados com cloridrato de betaína durante um período de 6 meses. Foi observada uma melhora geral na condição física e energia em todos os pacientes. Todos pacientes com sintomas indigestão e produção excessiva de gases obtiveram alívio com o tratamento. Sinais de inflamação na mucosa oral melhoraram em 78% dos pacientes e dos 22 pacientes com queixa de dor crônica bucal, 5 obtiveram completo alívio e outros 11 pacientes relataram melhora (SHARP; FISTER, 1963).
Alguns estudos têm demonstrado que o pH gástrico elevado pelo uso de agentes como inibidores da bomba de prótons (ex. rabeprazol) ou antagonistas de receptor H2 (ex. cimetidina) podem impactar significativamente na absorção de fármacos que exibem solubilidade pH-dependente, como é caso daqueles classificados como bases fracas. A despeito desse problema, há uma carência de estratégias clínicas práticas para mitigar esse tipo de interação. Com base nessa demanda, um estudo piloto avaliou recentemente a extensão e tempo de curso da reacidificação gástrica após a administração oral de forma farmacêutica oral sólida contendo cloridrato de betaína anidra em voluntários sadios com hipocloridria induzida farmacologicamente. Seis voluntários sadios inicialmente com normocloridria (pH gástrico em jejum < 4,0) foram recrutados nesse período único de estudo. A hipocloridria foi induzida via administração oral de 20mg de rabeprazol duas vezes ao dia durante quatro dias. No quinto dia, uma dose adicional de rabeprazol foi dada e o pH gástrico foi monitorado continuamente através do uso da cápsula de Heidelberg (técnica de radiotelemetria tradicionalmente usada para medir pH no trato digestivo). Após confirmação de pH gástrico > 4,0 para 15 minutos, 1500mg de cloridrato de betaína foram administrados via oral com 90 mL de água. O pH gástrico foi então continuamente monitorado por 2 horas. O cloridrato de betaína baixou significativamente o pH gástrico de 5,2 ± 0,5 unidades para 0,6 ± 0,5 unidade com uma redução média de 4,5 ± 0,5 unidades (P < 0,001) durante um intervalo de 30 minutos após a administração. O início do efeito do cloridrato de betaína foi rápido, com tempo médio para obter pH < 3,0 de 6,3 ± 4,3 minutos. O período de reacidificação foi temporário com pH gástrico < 3,0 e < 4,0 durando respectivamente 73 ± 33 minutos e 77 ± 30 minutos. O cloridrato de betaína foi bem tolerado por todos os indivíduos. O estudo concluiu que o cloridrato de betaína foi efetivo em voluntários sadios com hipocloridria induzida farmacologicamente, promovendo redução temporária do pH gástrico. O rápido início de ação e a duração relativamente curta da redução do pH confere ao cloridrato de betaína potencial para auxiliar na absorção de fármacos administrados via oral com característica de base fraca e com solubilidade pH-dependente quando ingeridos sob condições de hipocloridria (YAGO et al., 2013).
O uso do cloridrato de betaína para aumentar a absorção da dasatiniba, medicamento empregado no tratamento de leucemias, foi avaliado em voluntários sadios com hipocloridria induzida por rabeprazol através de um estudo clínico farmacocinético, aberto, cruzado, randomizado e envolvendo três formas de tratamento. A dasatiniba, assim como vários outros fármacos administrados via oral entre os quais também se incluem outros agentes anticâncer, exibe solubilidade dependente do pH. Fármacos redutores do pH gástrico podem potencialmente afetar negativamente a absorção e reduzir o efeito terapêutico desse fármaco. Nesse estudo os voluntários foram randomizados em três grupos para receber somente dasatiniba (100mg), dasatiniba (100mg) após pré-tratamento com rabeprazol (20mg 2x/dia) e dasatiniba (100mg) com 1500mg de cloridrato de betaína após pré-tratamento com rabeprazol (20mg 2x/dia). O objetivo desse estudo foi determinar se o cloridrato de betaína poderia aumentar a absorção da dasatiniba em condições de hipocloridria. Os resultados do estudo mostraram que o rabeprazol reduziu significativamente a concentração máxima ou pico de concentração plasmática (Cmax) e a área sob a curva (AUC = quantidade de fármaco que atinge a circulação sistêmica) em 92 e 78% respectivamente. Entretanto a coadministração de cloridrato de betaína aumentou significativamente a Cmax e AUC da dasatiniba em 15 e 6,7 vezes, restaurando ambos para 105 e 121% respectivamente em relação ao grupo controle (grupo dasatiniba somente). Portanto, cloridrato de betaína reverteu o impacto da hipocloridria na redução da biodisponibilidade da dasatiniba e poderia ser uma estratégia efetiva para mitigar interações fármaco-fármaco para medicamentos que exibem solubilidade pH-dependente e administrados via oral sob condições de hipocloridria (YAGO et al., 2014).
Conclusão
A hipocloridria/acloridria trata-se de condição clínica não regularmente considerada no diagnóstico médico e frequentemente subestimada ou negligenciada. Contudo, suas implicações no status nutricional, associação com diversas patologias e possíveis interferências na biodisponibilidade de alguns medicamentos são relevantes à saúde e devem ser por isso consideradas na prática médica. O benefício e eficácia da suplementação de cloridrato de betaína no aumento da função digestiva e na reacidificação do pH gástrico têm sido evidenciados em alguns estudos, advogando para seu uso na hipocloridria/acloridria e na melhora da qualidade de vida de pacientes com distúrbios digestivos.
Exemplos de formulações
1) Cápsulas com Cloridrato de Betaína
Cloridrato de betaína.................... 325 – 650mg
Excipiente qsp............................... 1 cápsula
Mande 90 cápsulas.
Indicações: acloridria, hipocloridria, auxiliar na digestão.
Posologia: Tomar 1 cápsula 3 vezes ao dia, administrado com água (antes, durante, após ou entre as principais refeições).
2) Cápsulas com Cloridrato de Betaína e Pepsina
Cloridrato de betaína.................... 388 mg
Pepsina........................................... 97 mg
Excipiente qsp............................... 1 cápsula
Mande 90 cápsulas.
Indicações: acloridria, hipocloridria, auxiliar na digestão.
Posologia: Tomar 1 cápsula 3 vezes ao dia, administrado com água (antes, durante, após ou entre as principais refeições).
3) Cápsulas com Cloridrato de Betaína e Pepsina
Cloridrato de betaína..................... 500 mg
Pepsina............................................ 40 mg
Excipiente qsp................................ 1 cápsula
Mande 90 cápsulas.
Indicações: acloridria, hipocloridria, auxiliar na digestão.
Posologia: Tomar 1 cápsula 3 vezes ao dia, administrado com água (antes, durante, após ou entre as principais refeições).
4) Composto digestivo com Cloridrato de Betaína e associações
Cloridrato de betaína.................... 155 mg
Pepsina........................................... 105 mg
Pancreatina.................................... 100 mg
Cloridrato de ácido L-glutâmico. 100 mg
Papaína........................................... 50 mg
Bromelina....................................... 30 mg
Excipiente qsp............................... 1 cápsula
Mande 90 cápsulas.
Indicações: auxiliar na digestão, auxiliar na redução da intolerância alimentar.
Posologia: Tomar 1 cápsula 3 vezes ao dia, administrado com água (antes, durante, após as principais refeições).
Referência:
1.NIWA Y., MIYACHI Y., ISHIMOTO K et al. Why are natural plant medicinal products effective in some patients and not in others with the same disease? Planta Med 1991; 57:299-304.
2.GABY A.R. Nutritional Medicine. Concord: Fritz Perlberg Publishing, 2011.p.432-435.
3.GRAY I., WALZER M. Studies in absorption of undigested proteins in human beings. VI. The absorption of unaltered protein from abnormal gastrintestinal tract. Am J Dig Dis 1936-7; 3:403-404.
4.SCHOLL I., UNTERMAYR E., BAKOS N. et al. Antiulcer drugs promote oral sensitization and hypersensitivity to hazelnut allergens in BALB/c mice and humans. Am J Clin Nutr 2005;81:154-160.
5.PIZZORNO J.E., MURRAY M.T. Textbook of Natural Medicine. 4th Ed. St. Louis: Elsevier Churchill Livingstone, 2013.
6.BRAY G. Hypochlorhydria of Asthma in Childhood. Quart. J. Med.1931;24:181.
7.YAGO M.A.R., FRYMOYER A.R., SMELICK G.S. et al. Gastric ication with Betaine HCl in Healthy Volunteers with Rabeprazole-induced Hypochlorhydria. Mol Pharm 2013;10(11):4032-4037.
8.RUDDEL WS, BONE ES, HILL MJ, WALTER CL. Pathogenesis of gastric câncer in pernicious anaemia. Lancet 1978;1(8063):521-3.
9.KELLY G.S. Hydrochloric Acid: Physiological Functions and Clinical Implications. Alt Med Ver 1997; 2(2):116-127.
10.YAGO M.R., FRYMOYER A., BENET L.Z. et al. The Use of Betaine HCl to Enhance Dasatinib Absorption in Healthy Volunteers with Rabeprazole-Induced Hypochlorhydria. AAPS Journal 2014; 16(6):1358-1365.
11.CORLETO V.D., FESTA S., Di Giulio E. et al. Proton pump inhibitor therapy and potential long-term harm. Curr Opin Endocrinol Diabetes Obes 2014; 21:3-8.
12. Thome Research Inc. Hydrochloric acid. Alternative Medicine Review Monographs 2002:208-211.
13.KNAPP MJ., BERARDI RR, DRESSMAN JB et al. Modification of gastric pH with oral glutamic acid hydrochloride. Clin Pharm.1991; 10(11):866-9.
14.WOSIKA PH. Glutamic acid hydrochloride as a substitute for dilute hydrochloric acid in achlorhydria. The American Journal of Digestive Diseases 1936; 3:335.
15.HENDLER SS., RORVIK DM. PDR for Nutritional Supplements. 2nd Ed. Montvale:Physicians’ Desk Reference Inc., 2008.p.80-83.
16.BLACOW NW. Martindale The Extra Pharmacopoeia. 26th Ed. London: The Pharmaceutical Press, 1972.p.879.
17.KRINSKY DL., LAVALLE JB, HAWKINS EB et al. Natural Therapeutics Pocket Guide. 2nd ed. Hudson: American Pharmaceutical Association, 2003.p.576-577.
18.SHARP GS, FISTER HW. The diagnosis and treatment of achlorhydria: ten-year study. J Amer Ger Soc 1967;15:786-791.